GUÍA 14 CIENCIAS CUARTO -COMPUESTOS MEZCLAS Y COMBINACIONES
|
|
COLEGIO LA AMISTAD I.E.D GUÍA DE TRABAJO ESTRATEGIA
APRENDE EN CASA JORNADA TARDE |
|
Materia |
CIENCIAS NATURALES- GUÍA 14 |
|
Docente |
HÉCTOR JULIO GUEVARA |
|
Ciclo/curso |
DOS/CUARTO |
|
Estudiante |
|
|
Fecha de desarrollo |
AGOSTO 10 AL 14 DE 2020 |
|
Competencias Representar mediante modelos atómicos la forma en que ocurren los
enlaces químicos para formar moléculas y compuestos químicos. |
|
|
Instrucciones
/procedimientos 1. Lee toda la guía antes de
realizar cualquier actividad. 2. Escribe qué es una mezcla, una
combinación, un compuesto y una fórmula química. 3. Dibuja la estructura molecular
del agua, de la sal y del azúcar. 4. Basado en la última gráfica,
representa la molécula de CO2 (dióxido de carbono). 5. Envía tus actividades al
correo profehectorj2020@gmail.com |
|
|
Contenidos. COMPUESTOS, MEZCLAS Y
COMBINACIONES En estos días que has
estado en casa, seguramente ayudaste a tus padres a preparar la comida y
utilizaste sustancias como la sal y el azúcar.
(Si deseas puedes observarlos con una lupa). Con estos nombres se conocen
popularmente, pero para los científicos son cristales de cloruro de sodio (NaCl) y glucosa (C6H12O6). Cuando respiramos ingresa Oxígeno (O2) a nuestros pulmones y eliminamos
gas carbónico o dióxido de carbono (CO2). Cómo puedes apreciar,
constantemente utilizamos compuestos químicos, que resultan de las
combinaciones y mezclas de diferentes elementos; los medicamentos, los
elementos de aseo, nuestros alimentos y hasta nosotros mismos somos el
resultado de las mezclas y combinaciones de sustancias químicas. Recordemos que una
mezcla se puede separar para obtener nuevamente las sustancias iniciales,
pero en una combinación no se pueden volver a obtener las sustancias de
partida y sus características cambian. Veamos los cristales de la sal de
cocina y la estructura molecular del agua, la sal y el azúcar: 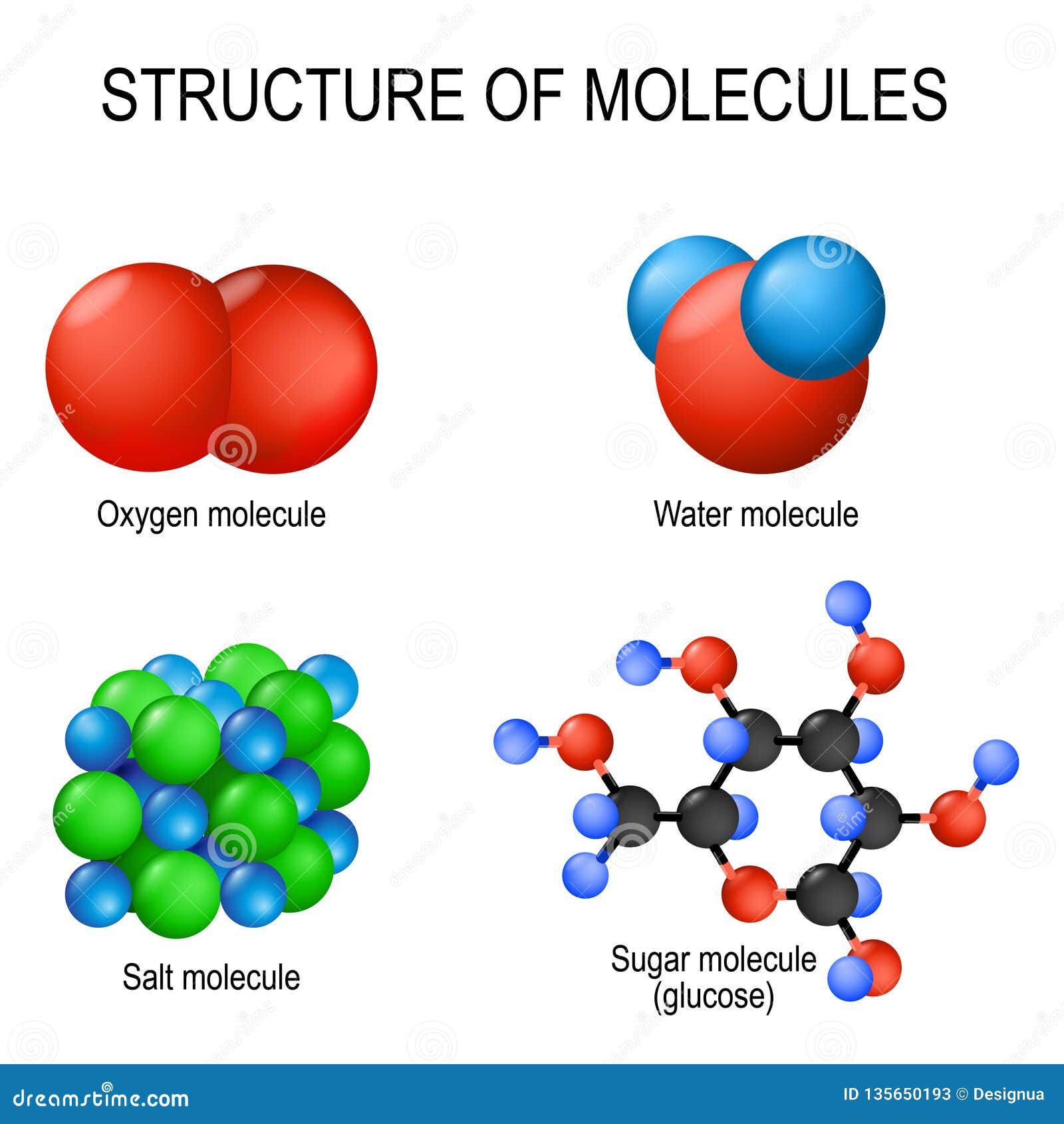 UN COMPUESTO es una sustancia pura
que aún se puede separar en otras más simples por métodos (reacciones)
químicos. Por ejemplo, el agua es una sustancia pura, pero si la sometemos a
electrolisis (proceso químico) la podemos separar en sus elementos
constituyentes: el oxígeno y el hidrógeno. Tanto en los elementos como en los
compuestos los átomos se unen entre sí mediante enlaces químicos. Las letras de
los elementos químicos y los números que representan las cantidades de átomos
que se unen o combinan dan como resultado la Fórmulas empírica y molecular. LA FÓRMULA MOLECULAR es la fórmula química que
indica el número y tipo de átomos distintos presentes en la molécula. La
fórmula molecular es la cantidad real de átomos que conforman una molécula.
Sólo tiene sentido hablar de fórmula molecular si el elemento o el compuesto
están formados por moléculas. Para que estas uniones ocurran es necesario que varios átomos interactúen compartiendo, perdiendo o ganando sus electrones de la última órbita, a este proceso lo conocemos como una reacción química. Observa cómo se forman dos moléculas de agua (H2O) a partir de 2 moléculas de H2 y una de O2: Ahora observa cómo se
forma una molécula de (CH4) metano y de (H2O) agua: |
|
|
Links profehectorj2020@gmail.com http://recursostic.educacion.es/newton/web/materiales_didacticos https://www.pinterest.cl/pin/801851908624064066/ |
|
|
Bibliografía Cárdenas, F. A.
(1998) Camino a la ciencia. Bogotá. Intermedio editor. Gómez, M. A. (1999)
Ingéniate. Ciencias naturales y de salud. Bogotá. Voluntad editores. Centeno, M. (2014)
Complemento escolar integrado. Bogotá. Libros y libros S.A. |
|



Q buen trabajo💖🌸💜😻😛
ResponderEliminarEs un largo trabajo jajaja😅😅❤️💜💝💖💞❣️
ResponderEliminar